Aufbau des Kugelwolkenmodells
Zur Einführung des Kugelwolkenmodells in den Chemieunterricht dienen zunächst die einfachen fünf Regeln:
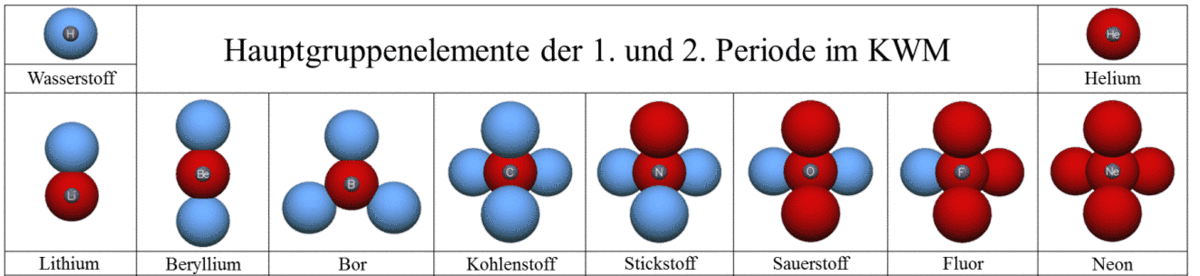
- Protonen und Neutronen befinden sich im Atomkern; Elektronen in „kugelförmigen Ladungswolken“ (kurz: Kugelwolken) um den Kern herum.
- In einer Kugelwolke können sich maximal zwei Elektronen aufhalten. Einfach besetzte Kugelwolken werden mit der Farbe Blau und doppelt besetzte Kugelwolken mit der Farbe Rot gezeichnet.
- In der äußersten Energiestufe können sich nie mehr als 8 Elektronen
(also maximal 4 Kugelwolken) befinden, wobei die Kugelwolken den größtmöglichen Abstand zueinander einnehmen. - Die Kugelwolken einer Energiestufe werden zunächst alle einfach und dann doppelt besetzt.
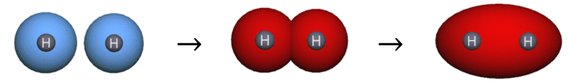
- Bindungen entstehen durch Überlappung einfach besetzter Kugelwolken.
Die für den Schulunterricht entworfenen Regeln liefern auf den zweiten Blick mehr als zunächst erwartet, denn in den Regeln findet man wesentliche wissenschaftliche Konzepte und Prinzipien wieder.
So ist in der ersten Regel der Begriff „Ladungswolke“ auf das Orbitalmodell zurückzuführen. Die nach außen abnehmende Aufenthaltswahrscheinlichkeit der Elektronen wird im KWM zur Vereinfachung als abgeschlossene Kugelwolke dargestellt. Die Elektronen werden nicht gezeichnet, da deren exakter Aufenthaltsort und Impuls (nach der Heisenbergʼschen Unbestimmtheitsbeziehung) nicht bestimmt werden kann.
Hinter der zweiten Regel verbirgt sich das Pauli-Prinzip, nach dem sich sinngemäß in einem Orbital (Kugelwolke) maximal zwei Elektronen mit entgegengesetztem Spin aufhalten dürfen.
Die dritte Regel beinhaltet zum einen die Oktettregel, nach der Atome der 2. Periode in ihren „Außenschalen“ maximal 8 Elektronen unterbringen können und zum anderen den Grundmechanismus des Coulombʼschen Gesetzes, wonach sich Ladungen mit gleichem Vorzeichen abstoßen und mit unterschiedlichen anziehen.Dieses Prinzip findet sich ebenfalls beim VSEPR-Modell wieder, wonach bindende und nichtbindende Elektronenpaare den größtmöglichen Abstand zueinander einnehmen [1, S. 314]. Auf diese Weise können im Kugelwolkenmodell viele einfache Molekülstrukturen sowie ihre Bindigkeit vorhergesagt werden.
Diese vortreffliche Eigenschaft weist im Vergleich das originäre Orbitalmodell nicht auf. Erst durch das von Linus Pauling 1931 eingeführte Konzept der Hybridisierung sind Strukturvorhersagen mit dem Hybridorbitalmodell (HO-Modell) möglich geworden [1, S. 361].
Die Beschreibung zur Besetzungsreihenfolge der Energiestufen aus der vierten Regel entspricht der (zweiten) Hundʼschen Regel:
„Die Orbitale einer Unterschale werden so besetzt, dass die Anzahl der Elektronen mit gleicher Spinrichtung maximal wird.“ [2, S. 55]
Die letzte Regel kann als Vereinfachung der σ-Bindungsbildung (positive Überlappung) im Orbitalmodell [2, S. 106 f.] gesehen werden. Die Ausbildung eines gemeinsamen Elektronenpaares wird im KWM durch eine rote elliptische Kugelform visualisiert (siehe Abb.1). Eine Differenzierung zwischen σ- und π-Bindungen ist im KWM nicht vorgesehen.
Befolgt man die oben beschriebenen Regeln, so lassen sich für die Hauptgruppen der ersten zwei Perioden im PSE die Elemente wie folgt darstellen (siehe Abb. 2).
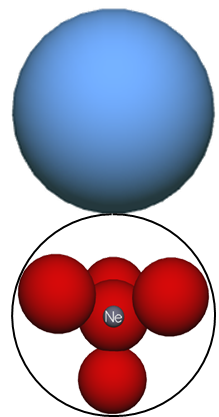
Ab der dritten Periode ist eine neue Energiestufe erreicht, da bereits beim Element Neon alle vier Elektronenwolken doppelt besetzt sind.
Eine neue Energiestufe wird durch die kugelförmige Umschließung der unteren Energiestufe dargestellt (siehe Abb. 3).
Auf diese Weise lassen sich, wie bisher gewohnt, weitere Kugelwolken hinzufügen, bis die nächste Energiestufe wieder erreicht ist, usw.
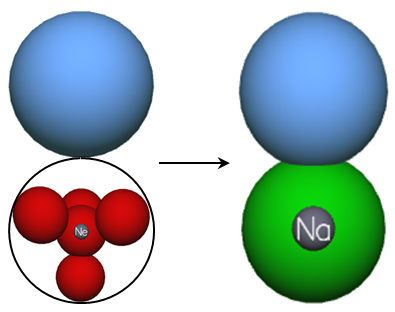
Der Tatsache geschuldet, dass nur Valenzelektronen für chemische Bindungen relevant sind, wird die zeichnerische Vereinfachung vorgenommen, dass Kugelwolken der Edelgaskonfiguration vereinheitlicht als grüne Kugelwolken dargestellt werden dürfen (siehe Abb. 4).
Neben der illustrierten Vereinfachung wird zudem der Fokus wieder auf die Valenzelektronen gerichtet. Natürlich lassen sich auch die Hauptgruppenelemente der vierten bis siebten Periode im Kugelwolkenmodell darstellen, da sie aber keine strukturellen Unterschiede zur dritten Periode aufweisen, sind sie hier nicht weiter aufgeführt.
[1] Hollemann, A.F.; Wiberg, N.: Lehrbuch der Anorganischen Chemie - 102. Auflage, Walter de Gruyter Verlag, Berlin 2007
[2] Riedel, E.; Janiak C.: Anorganische Chemie – 7. Auflage, Walter de Gruyter Verlag, Berlin 2007