Ursprung und Entwicklung
Der Ursprung des Kugelwolkenmodells geht auf das Jahr 1956 zurück, in dem die amerikanischen Quantenchemiker Prof. George E. Kimball und G. F. Neumark einen Artikel über vereinfachte Molekülberechnungen beim „Journal of Chemical Physics“ einreichten [1].
Hintergrund des Artikels war, dass das seit 1925 bekannte quantenmechanische Orbitalmodell [2] zwar in jeder Hinsicht befriedigende Ergebnisse zu Molekülberechnungen lieferte, jedoch dessen Komplexität durch die verschiedenen Orbitalformen (s, p, d, f) einen erheblichen mathematischen Aufwand notwendig machten. Zur damaligen Zeit standen den Forschen noch keine leistungsstarken Computer oder Taschenrechner zur Verfügung, so dass die meisten Berechnungen mit Stift, Papier und Tabellenwerk durchgeführt wurden. (Taschenrechner gab es erst ab 1972! [3]) Entsprechend musste man viel geistige Kraft und Zeit investieren, um Molekülberechnungen durchzuführen.
Nachteilig waren weiterhin die geringe Anschaulichkeit des Orbitalmodells und die damit verbundenen Lernschwierigkeiten bei den Studenten. Aus diesen Gründen war Kimball bestrebt, ein weniger rechenaufwendiges Atommodell zu entwickeln, das trotz Vereinfachung gute Ergebnisse bei Molekülberechnungen hervorbringt.
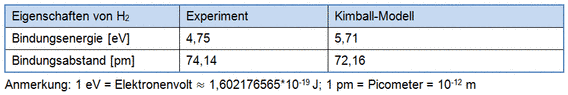
Seine Grundidee bei der Umsetzung des Modells war es, anstelle der variationsreichen Orbitalformen, einfache kugelförmige Orbitale zu verwenden [sinngemäß nach 1]. Die ersten Berechnungen mit Kimballs Modell erzielten, trotz der Vereinfachung überraschend gute Ergebnisse. Exemplarisch sind hier zum Vergleich die Bindungsenergie und der Bindungsabstand vom molekularen Wasserstoff aufgeführt (siehe Tabelle).
Entgegen den guten Ergebnissen und der erfüllten Zielstellung ist das Kimball-Modell leider nie in den wissenschaftlichen Evaluationsprozess übergegangen, da Kimball bereits im Alter von 61 Jahren aufgrund einer Herzkrankheit gestorben ist und infolgedessen keine umfassende Darlegung seiner Ideen herausbringen konnte [5].
Dennoch inspirierte Kimballs Ansatz den Chemiker Prof. Henry A. Bent zu einer eigenen Interpretation des Kimball-Modells – dem „Tangent- Sphere Model“ (TSM).
Das TSM wurde 1963, also 6 Jahre nach Kimballs Artikel, im Journal of Chemical Education veröffentlicht [6]. Bent bezog sich in dem Artikel auf Kimballs Arbeit und übernahm die Idee der kugelförmigen Aufenthaltsräume für die Umsetzung seines TSM, was im Nachhinein zu der Annahme führte, dass das Kimball-Modell kein wissenschaftlich fundiertes Modell darstellt. Denn im Gegensatz zum Kimball-Modell ist das TSM nicht für wissenschaftliche Berechnungen geeignet, da es die intramolekularen Anziehungs- und Abstoßungskräfte nicht quantitativ berücksichtigt [7].
Bents Modell ist aber in der Lage auf einfache und anschauliche Weise Molekülstrukturen sowie deren Bindigkeit in kurzer Zeit und mit nur wenigen Regeln (sogar ohne Hybridisierung) richtig herzuleiten. Es ist daher ein hervorragendes Modell, um erste Zusammenhänge zwischen Struktur und Bindigkeit für Lernende einzuführen [8].
Möchte man nun Kimballs Modell mit Bents TSM vergleichen und bewerten, so muss stets differenziert werden, welches Ziel mit welchem Modell verfolgt wird!
Blickt man in die Gegenwart so stellt man fest, dass das von Bent entwickelte Tangent-Sphere-Modell die Grundlage für das im deutschsprachigen Raum anzutreffende Kugelwolkenmodell (KWM) ist. Ironischer Weise werden aber die Bezeichnungen „Kugelwolkenmodell“ und „Kimball-Modell“ häufig synonym verwendet, obwohl den Modellen unterschiedliche Einsatzzwecke zuzuordnen sind.
Die Weiterentwicklung des TSM zum gegenwärtigen Kugelwolkenmodell ist über die Jahre variationsreich ausgefallen. So findet man in der Literatur und im Internet oft unterschiedliche Darstellungen vom Kugelwolkenmodell [9] [10] [11] [12]. Eine erste Umsetzung des KWM in deutschen Schulbüchern führte H.R. Christen 1974 ein [9]. In den darauffolgenden Jahren von etwa 1974 bis 1985 ist das KWM in deutschen Schulbüchern präsent. Ab 1986 verschwand es aber zunehmend in den Lehrbüchern und wurde durch das Elektronenschalenmodell (ESM) ersetzt [13]. Dennoch findet man das KWM auch heute noch auf Bildungsservern, privaten Homepages von Lehrern und in diversen Unterrichtsmaterialien [12][14][15][16]. Unabhängig von der Präsenz in den Schulbüchern ist das KWM für viele Lehrende und Lernende weiterhin attraktiv geblieben.
Wir sehen das in unserer Arbeitsgruppe ähnlich, denn wenn man sich mit dem KWM näher beschäftigt, werden viele Vorteile und nur wenige Nachteile deutlich. Infolgedessen möchten wir Ihnen auf den nachstehenden Seiten eine sich für uns in der Schule bewährte Umsetzung des KWM vorstellen.
[1] G. E. Kimball, G. F. Neumark: Use of Gaussian Wave Functions in Molecular Calculations, The Journal of Chemical Physics Volume 26, Number 5, 1957
[2] Hollemann, A.F.; Wiberg, N.: Lehrbuch der Anorganischen Chemie - 102. Auflage, Walter de Gruyter Verlag, Berlin 2007, S. 328
[3] CASIO COMPUTER CO., LTD. – Webpräsenz, URL: world.casio.com/corporate/history/chapter01/contents02/ (Abfrage: 30.08.2013, MEZ 12:36 Uhr)
[4] E. Schumacher: Kimball’s Ansatz – Begleittext zur Programmsammlung CHEMUNT: Einführung in das quantitative Kimball-Modell, Chemsoft 2002, S. 12, URL: www.kimball-model.org/Kimball/kimb9.pdf (Abfrage: 30.08.2013, MEZ 12:50 Uhr)
[5] Philip M. Morse: George Elbert Kimball – A Biographical Memoir, National Academy of Sciences Washington D. C. 1973, S. 140
[6] Henry A. Bent: Tangent-Sphere Models of Molecules, Journal of Chemical Education, Volume 40, Number 9, 1963
[7] E. Schumacher: kimball-model.org – Webpräsenz, URL: www.kimball-model.org/Kimball/commenttsa.htm (Abfrage: 30.08.2013, MEZ 13:43 Uhr)
[8] Ethel L. Schultz: Tangent Sphere Model – An Analog to Chemical Structure, Journal of Chemical Education, Volume 63, Number 11, 1986
[9] Christen, H. R.: Struktur, Stoff, Reaktion, Diesterweg, Frankfurt/Berlin/München 1974, S. 121
[10] Wikipedia – Freie Enzyklopädie, URL: de.wikipedia.org/wiki/Kugelwolkenmodell (Abfrage: 30.08.2013, MEZ 15:44 Uhr)
[11] Deutsche Schule Kuala Lumpur –Webpräsenz, URL: www.dskl.edu.my/UVM/lehrerinnenweb_aktuell/animationen/avi/kohlenstoff.avi (Abfrage: 30.08.2013, MEZ 16:22 Uhr)
[12] U-Helmich.de – Webpräsenz, URL: www.u-helmich.de/che/0809/05-molek/mol01.html (Abfrage: 30.08.2013, MEZ 14:07 Uhr)
[13] M. Tausch; Atom, Molekül, Mol – eine Schulbuchsynopse über 80 Jahre, Praxis der Naturwissenschaften – Chemie, Heft Nr. 7, 43. Jahrgang, 1994
[14] Landesbildungsserver Baden-Württemberg, URL: www.schule-bw.de/unterricht/faecher/chemie/medik/modell/mod4.html (Abfrage: 30.08.2013, MEZ 13:57 Uhr)
[15] Bildungsserver SwissEduc, URL: www.swisseduc.ch/chemie/schwerpunkte/kwm/docs/kimball.pdf (Abfrage: 30.08.2013, MEZ 14:15 Uhr)
[16] Chemiezauber.de – Webpräsenz, URL: https://chemiezauber.de/inhalt/basic-1/ein-neues-atommodell-muss-her/das-kugelwolkenmodell.html (Abfrage: 30.08.2013, MEZ 14:04 Uhr)