Vergleich und Eignung
Ausgehend von der Frage nach einem zeitgemäßen und schülergerechten Atommodell für den Chemieunterricht, wurden etablierte Atommodelle hinsichtlich ihrer Leistungsfähigkeit und Eignung überprüft.
Die Leistungsfähigkeit eines Modells hängt von den gestellten Kriterien ab, nach denen es bewertet werden soll. Die Kriterien zur Bewertung orientieren sich wiederum an dem jeweiligen Einsatzgebiet. Es muss daher zunächst das Einsatzgebiet festgelegt werden.
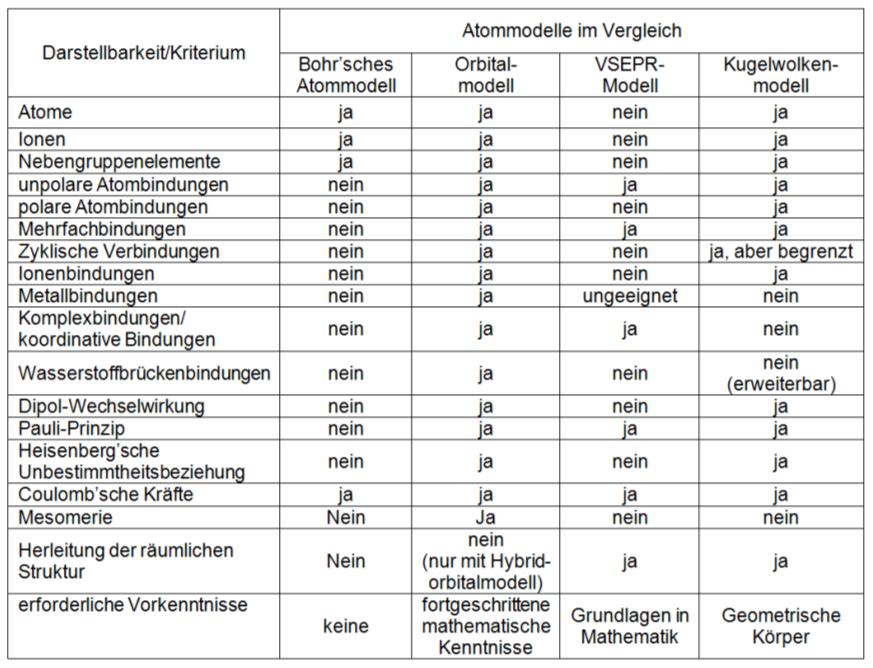
Die Zielstellung soll hier ein Modell sein, welches möglichst viele Phänomene des Chemieunterrichtes der Sekundarstufe I und II erklären kann und gleichermaßen leicht zugänglich bleibt. Zur Bewertung der Leistungsfähigkeit werden vergleichend das Bohrʼsche Atommodell, das Orbitalmodell, das VSEPR-Modell und das Kugelwolkenmodell herangezogen. Um einen Überblick zu bekommen, sind die Eigenschaften der Atommodelle tabellarisch zusammengefasst:
Aus der Tabelle wird ersichtlich, dass das Orbitalmodell fast alle Kriterien erfüllt und damit die meisten Phänomene erklären kann. Schwächen weist es nur beim Herleiten von räumlichen Strukturen auf, für die es Informationen bezüglich der Hybridisierungsform einfordert. Das Orbitalmodell ist somit das fachlich präferierte Atommodell. Es erfüllt allerdings nicht die wesentliche Zielstellung der leichten Zugänglichkeit, da es fortgeschrittene mathematische Kenntnisse erfordert. Gerade für Chemieanfänger, also Schüler der Sekundarstufe I, ist dieses mathematisch aufwendige Modell schwer zu erlernen bzw. zu verstehen.
„Die letzte Stufe, die des formal-operationalen Denkens, wird nicht von allen heranwachsenden Kindern und Jugendlichen zum selben Zeitpunkt und in derselben Reife erreicht. Amerikanische Untersuchungen gehen davon aus, dass etwa 60% aller College-Studenten in Tests repräsentiertes formales Denken produzieren können.“ [1]
Berücksichtigt man weiterhin, dass die meisten Schüler in der Sekundarstufe I zum Zeitpunkt ihrer ersten Chemiestunden in der 7. oder 8. Klassenstufe ein Alter von etwa 12–15 Jahren erreicht haben, so wird deutlich, dass der Großteil der Schüler das Orbitalmodell aufgrund des geistigen Entwicklungsstandes noch nicht wirklich verstehen kann. Es ergibt sich daraus die Konsequenz, ein weniger anspruchsvolles Modell für die Einstiegsphase des Chemieunterrichts zu wählen.
Entscheidet man sich für das leicht zu erlernende Bohrʼsche Atommodell, so würde man schnell an die Grenzen des Modells gelangen, weil es insgesamt zu wenige Kriterien erfüllt und kaum etwas zum Verständnis von Bindungen beiträgt. Man wäre innerhalb weniger Unterrichtseinheiten gezwungen das Bohrʼsche Atommodell zugunsten eines weiteren Atommodells aufzugeben. Erschwerend ist die Tatsache, dass dieses Modell dem aktuellen Kenntnisstand der Forschung nicht gerecht wird und ein völlig anderes, unzutreffendes Bild vom Atomaufbau zeichnet.
Wählt man das VSEPR-Modell (kein Atom- sondern ein Bindungsmodell), so sei darauf hingewiesen, dass dieses Modell zur Darstellung von einzelnen Atomen und Ionen untauglich ist, da es inhaltlich auf die Herleitung und Vorhersage von Molekülstrukturen abzielt und wichtige Bindungstypen wie Ionenbindungen oder polarisierte Atombindungen unberührt lässt. Es ist demnach für die Einstiegsphase im Chemieunterricht, wo beispielsweise der Aufbau vom PSE behandelt wird, ungeeignet.
Betrachtet man die erfüllten Kriterien des Kugelwolkenmodells, so kann dieses Modell zwar nicht alle fachlichen Forderungen vollständig erfüllen, aber es vermag, die für die Einstiegsphase des Chemieunterrichtes und darüber hinaus erforderlichen Bereiche gut abzudecken, indem es Atome und Ionen sowie Verbindungen der Hauptgruppenelemente, unter Einbeziehung der Heisenbergʼschen Unbestimmtheitsbeziehung, des Pauli-Prinzips und der Coulombʼschen Kräfte, darstellen kann. Die fachlichen Vorkenntnisse beschränken sich auf nur wenige Grundlagen der Chemie und erfordern kein vertieftes mathematisches Verständnis.
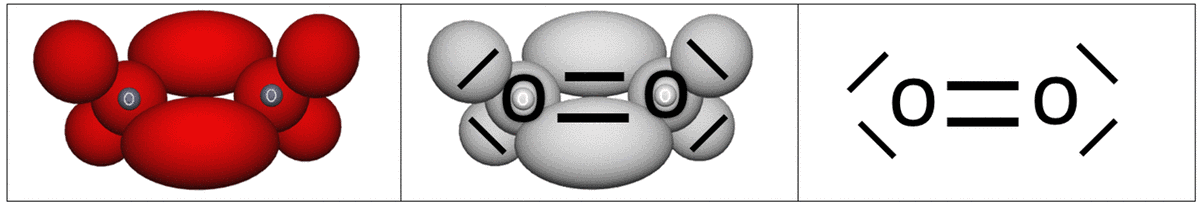
Für den fortgeschrittenen Unterricht lassen sich mit Einschränkungen polarisierte Bindungen, Doppel- und Dreifachbindungen sowie zyklische Bindungen und ihre Konformationen darstellen. Darüber hinaus können mit dem vom VSEPR-Modell entlehnten Prinzip der Elektronenpaarabstoßung räumliche Molekülstrukturen und Bindungsverhältnisse, mit einer für den Schulunterricht ausreichenden Genauigkeit, vorherbestimmt werden. Ein weiterer Vorteil des Kugelwolkenmodells besteht in der einfachen Überführungsweise der Kugelwolkenmoleküle in Lewis-Struktur-Formeln. Dazu müssen die
- einfach besetzten Kugelwolken gegen Punkte,
- die doppelt besetzten Kugelwolken gegen kurze Striche und
- die Bindungen zwischen den Kugelwolkenatomen durch längliche Striche
ersetzt werden (siehe Abb. 1).
Gelangt man inhaltlich an die Grenzen des Kugelwolkenmodelles, so ist es relativ unproblematisch vom Kugelwolkenmodell zum Orbitalmodell zu überführen, denn das Kugelwolkenmodell basiert auf den gleichen wissenschaftlichen Prinzipien wie das Orbitalmodell (vgl. Erläuterungen zu KWM-Regeln).
Im Rahmen der aufgestellten Kriterien ist das Kugelwolkenmodell als ein sehr leistungsfähiges Modell zu bewerten. Zwar eignet es sich nicht zur Darstellung von Metall- und Komplexbindungen oder Resonanzstrukturen, aber dafür kann es beginnend vom Chemieanfangsunterricht bis hin zum fortgeschrittenen Unterricht der Sekundarstufe II als Erklärungsmodell für die meisten behandelten Phänomene eingesetzt werden.
[1] Fend, H.: Entwicklungspsychologie des Jugendalters, 3. Auflage, VS Verlag für Sozialwissenschaften/GWV Fachverlage GmbH, Wiesbaden 2005, S.123